タヒボNFD特許公報 特許第2669762号
(19)【発行国】日本国特許庁(JP)
(12)【公報種別】特許公報(B2)
(11)【特許番号】第2669762号
(24)【登録日】平成9年(1997)7月4日
(45)【発行日】平成9年(1997)10月29日
(54)【発明の名称】2―(1―ヒドロキシエチル)―5―ヒドロキシナフト〔2,3―b〕フラン―4,9―ジオンを含有する発癌プロモーション阻害剤
(51)【国際特許分類第6版】
A61K 31/34 ADU
35/78
C07D307/92
【FI】
A61K 31/34 ADU
35/78
C
C07D307/92
【請求項の数】1
【全頁数】36
(21)【出願番号】特願平5−35251
(22)【出願日】平成5年(1993)2月24日
(65)【公開番号】特開平6−145162
(43)【公開日】平成6年(1994)5月24日
【審判番号】平7−8622
(31)【優先権主張番号】特願平4−249340
(32)【優先日】平4(1992)9月18日
(33)【優先権主張国】日本(JP)
(73)【特許権者】
【識別番号】999999999
【氏名又は名称】タヒボジャパン 株式会社
【住所又は居所】
(72)【発明者】
【氏名】上田 伸一
【住所又は居所】
(72)【発明者】
【氏名】徳田 春邦
【住所又は居所】
(72)【発明者】
【氏名】平井 圭一
【住所又は居所】
(72)【発明者】
【氏名】畠中 平八
【住所又は居所】
(74)【代理人】
【弁理士】
【氏名又は名称】青山 葆 (外1名)
【合議体】
【審判長】吉村 康男
【審判官】宮本 和子
【審判官】谷口 浩行
(56)【参考文献】
【文献】特開 昭63−196576(JP,A)
【文献】特開 平4−139177(JP,A)
(57)【特許請求の範囲】
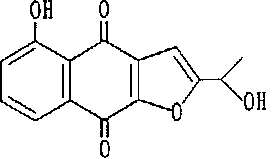
【請求項1】 下記構造式で示される2−(1−ヒドロキシエチル)−5−ヒドロキシナフト[2,3−b]フラン−4,9−ジオンを必須成分とする発癌プロモーション阻害剤:【化1】
【発明の詳細な説明】
【0001】本発明は、抗癌活性を有する新規化合物およびそれを含有する抗癌剤に関する。
【0002】癌による死亡者数は年々増加し今日先進国死亡率の最大の原因となっており、癌制圧は医療における最重要課題である。癌の治療において大きなテーマの一つは抗癌剤の開発であり、過去多種多様の抗癌剤が開発されてきた。癌細胞に直接作用し殺細胞性を発揮するものとして多数の抗生物質等が開発されてきたが同時に正常細胞や正常組織に対する毒性も強く、重篤な副作用を招来することが多くの場合避けられなかった。従って効果的な医療を行うために、副作用が少なく癌細胞に対し選択的な細胞毒性を発揮する抗癌剤の開発が待たれている。
【0003】癌細胞の特性は十分に解明されるに至っていないが、今日、発癌性化学物質、放射線、紫外線あるいは発癌性ウイルス等の刺激によって細胞染色体に潜在する癌遺伝子が発現するか、反対に癌抑制遺伝子が不活性化隠蔽されるために癌遺伝子産物を作り出すようになると考えられている。癌遺伝子産物が細胞内外に分泌されるかあるいは細胞膜に分布するようになることで、癌細胞特有の性質である転移浸潤能や無常軌な増殖能を獲得することと関係があると考えられている。これらの異常に発現した系を断ち切ることが可能になれば癌制圧の有効な手段となることが期待される。
【0004】一方、従来から、抗癌剤の有効性を調べるために、我国に於いては、米国NCI(National Cancer Institute)の基準に準拠し、マウス白血病L1210及びP388細胞を用いたスクリーニングを常法としている。しかし同法における試験成績がヒト癌患者による臨床試験成績と一致することはむしろ少なかった。最近、NCIはヒト癌細胞株を用いる新スクリーニング方式を採用し、この方式による成績と臨床有効例との間に強い相関があることを認めるに至った(G.B.Grindey:Cancer Cells.2巻6号163〜171頁、1990及び西條長宏:臨床医17巻6号4〜9頁、1991)。
【0005】本発明者らは、かかるヒト癌細胞を使用する新スクリーニング方式により種々の物質の抗癌作用を調べる内、ノウゼンカズラ科の植物、タヒボ(Tabebuia avellanedae Lorentz,ex Griseb.)に含まれる新規化合物、2−(1−ヒドロキシエチル)−5−ヒドロキシナフト[2,3−b]フラン−4,9−ジオン(略称:NFD)が優れた抗癌作用を有することを見い出した。本発明は、かかる知見に基づき完成されたものである。即ち、本発明は、式:【化2】
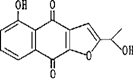
で示される新規化合物、NFDを提供するものである。更に本発明は、NFDを有効成分として含有する抗癌剤を提供するものである。
【0006】更に本発明は、タヒボの乾燥樹皮を温メタノールで抽出し、メタノールを留去して得られる残渣をクロロホルムで冷浸し、クロロホルム可溶成分をトルエン/酢酸エチルエステル(4:1)を展開溶媒とするプレパラティブ薄層クロマトグラフィーによって分離することからなるNFDの製造方法を提供するものである。
【0007】NFD(分子式:C14H10O5;分子量:258.230)はジメチルスルホキシド、クロロホルムに易溶、水に難溶の、融点181℃の黄色針状結晶である。
【0008】NFDは、培養ヒト肺腺癌A−549細胞、VMRC−LCD細胞、SK−LU−1細胞、ヒト肺扁平上皮癌Calu−1細胞、ヒト結腸腺癌WiDr細胞、ヒト前立腺癌LNCaP細胞、ヒト膣扁平上皮癌A−431細胞、ヒト子宮頚癌HeLa細胞、ヒト胆道癌HuCC−T1細胞、マウス皮膚癌メラノーマB16(M4)細胞、ヒトB型悪性リンパ腫細胞、ヒト慢性骨髄性白血病K562細胞、ヒト膵臓癌ASPC−1細胞、ヒト神経芽腫IMR−132細胞、ヒト肺小細胞癌SCCH−194細胞、ヒト膀胱癌T24細胞、ヒト腎癌VMRC−RCW細胞、ヒト胃癌NUGC−2細胞、ヒト甲状腺癌8305C細胞、ヒト乳癌MRK−nu−1細胞、ヒト肝癌HuH−7細胞、ヒト卵巣癌TYK−nu細胞、ヒト絨毛上皮癌BeWo細胞等に対し低濃度でその増殖を強く阻害し、さらにこれらの腫瘍細胞に対し選択的な毒性を有する。
【0009】上記の悪性腫瘍細胞に対するLD50値(50%増殖阻害値:IC50値と同意)はほぼ5.5〜25ng/mlの範囲にある。一方、培養ヒト正常線維芽細胞N6KA細胞、ヒト正常気管上皮細胞、ヒト正常腎細胞及びヒト正常リンパ球に対するLD50値(IC50値)は55〜84ng/mlの範囲にある。ICRマウス(雄)に対し腹腔内投与による毒性LD50値は0.73mg/100g体重、経口投与による毒性LD50値は0.84mg/100g体重である。
【0010】以上述べたことから明らかな様に、NFDは種々の癌に対し安全に使用することができる極めて優れた抗癌剤である。尚、NFDは、正常細胞が化学発癌物質やウイルスによって癌細胞に移行する際の重要な過程であるプロモーション段階に作用し、抗発癌プロモーターとしての機能をも有することがわかった。従って、本明細書に於いて抗癌剤とは、固形癌、血液癌、肉腫などのあらゆる悪性腫瘍に対して有効に作用し、これを治癒、軽減せしめると共に、これらの悪性腫瘍の発生を防止する薬剤を意味するものとする。以下、実施例を挙げて本発明をより詳細に説明する。
【0011】実施例1 NFDの製造タヒボの乾燥樹皮(ブラジル産;タヒボジャパン株式会社より販売)1kgを細切し、メタノール1000ml宛で30分3回加熱還流下に抽出、溶媒を減圧留去した。残渣(145g)をクロロホルム400ml宛で3回冷浸し、クロロホルム層を水洗後、硫酸マグネシウムで乾燥し、溶媒を留去して残渣1gを得た。これをトルエン・酢酸エチルエステル(4:1)を展開溶媒として、厚さ0.5mmのシリカゲル60F254を用いてプレパラティブ薄層クロマトグラフィーを行い、Rf=0.24のスポットをかきとり、クロロホルム−メタノール(容積比9:1)で抽出してNFDを得た。この薄層クロマトグラフィーを反復し、計0.8mgのNFDを得た。融点181℃。
【0012】実施例2 ヒト固形癌細胞、血液癌細胞、肉腫等を含む悪性腫瘍に対するNFDの抗癌作用(1)試料の調製秤量したNFDをDMSOに溶解し、1.0mg/ml原液を調製し、必要により随時希釈して使用した。
【0013】(2)NFDの抗癌性(増殖抑制及び致死作用)試験NFDによるヒト癌細胞(一部マウス癌細胞を含む)に対する抗癌作用は下記の方法で試験した。対数増殖期後半のヒト肺腺癌A−549細胞、VMRC−LCD細胞、SK−LU−1細胞、ヒト肺扁平上皮癌Calu−1細胞、ヒト結腸腺癌WiDr細胞、ヒト前立腺癌LNCaP細胞、ヒト膣扁平上皮癌A−431細胞、ヒト子宮頚癌HeLa細胞、ヒト胆道癌HuCC−T1細胞、マウス皮膚癌メラノーマB16(M4)細胞、ヒト膵臓癌ASPC−1細胞、ヒト神経芽腫IMR−132細胞、ヒト肺小細胞癌SCCH−194細胞、ヒト膀胱癌T24細胞、ヒト腎癌VMRC−RCW細胞、ヒト胃癌NUGC−2細胞、ヒト甲状腺癌8305C細胞、ヒト肝癌HuH−7細胞、ヒト卵巣癌TYK−nu細胞、ヒト絨毛上皮癌BeWo細胞をトリプシン処理(0.25%トリプシンと0.02%EDTAを含む、37℃、3分間)により採取したものを用い、ヒト乳癌MRK−nu−1細胞、ヒトB型悪性リンパ腫細胞及びヒト慢性骨髄性白血病K562細胞は浮遊培養により採取したものを用いた。一方、正常細胞については、対数増殖期後期の線維芽細胞N6KA細胞はトリプシン処理により採取したものを用い、正常気管上皮細胞及び正常腎細胞は直接採取したものを用い、正常リンパ球は健常成人末梢血から採取したものを用いた。これらの細胞を96穴マイクロプレートに5〜10×103細胞/cm2の密度になるように10%胎仔牛血清を含むDMEM培地またはRPMI−1640培地等を用いて播種し、定法に従って24時間培養した。培養後DMSOに溶解したNFDを各々一定量添加して、24、48、72時間後の生細胞数を調べた。なお、NFDの溶媒であるDMSOの影響を避けるため、DMSOの最終濃度が毒性のない0.5%以下になるように配慮し、DMSOのみを添加したものをコントロールとした。
【0014】(3)生細胞数の計測96穴マイクロプレート上で増殖した細胞をトリプシン処理で採取し、これに0.25%トリパンブルーを加えた時、染色されない細胞を生細胞とし、青く染色される細胞を死細胞とした(トリパンブルー排除法)。
【0015】(4)試験した癌細胞及び正常細胞a)ヒト肺腺癌(A−549細胞)
ヒト肺腺癌A−549細胞は、Flow Labo Inc.から入手し、10%胎仔牛血清を含むDMEM培地(50IU/mlペニシリン及び50μg/mlストレプトマイシンを含む)で37℃、5%CO2条件下に継代培養したものを用いた。
【0016】b)ヒト肺腺癌(VMRC−LCD細胞)
ヒト肺腺癌VMRC−LCD細胞は、国立衛生試験所から入手し、10%胎仔牛血清を含むDMEM培地(50IU/mlペニシリン及び50μg/mlストレプトマイシンを含む)で37℃、5%CO2条件下に継代培養したものを用いた。
【0017】c)ヒト肺腺癌(SK−LU−1細胞)
ヒト肺腺癌SK−LU−1細胞は、(財)放射線影響研究所から入手し、10%胎仔牛血清を含むDMEM培地(50IU/mlペニシリン及び50μg/mlストレプトマイシンを含む)で37℃、5%CO2条件下に継代培養したものを用いた。
【0018】d)ヒト肺扁平上皮癌(Calu−1細胞)
ヒト肺扁平上皮癌Calu−1細胞は、(財)放射線影響研究所から入手し、10%胎仔牛血清を含むDMEM培地(50IU/mlペニシリン及び50μg/mlストレプトマイシンを含む)で37℃、5%CO2条件下に継代培養したものを用いた。
【0019】e)ヒト結腸腺癌(WiDr細胞)
ヒト結腸腺癌WiDr細胞は、食品薬品安全センター、秦野研究所から入手し、10%胎仔牛血清を含むDMEM培地(50IU/mlペニシリン及び50μg/mlストレプトマイシンを含む)で37℃、5%CO2条件下に継代培養したものを用いた。
【0020】f)ヒト前立腺癌(LNCaP細胞)
ヒト前立腺癌LNCaP細胞は、香川医科大学内分泌内科学教室から入手し、10%胎仔牛血清を含むRPMI−1640培地で37℃、5%CO2条件下に培養したものを用いた。
【0021】g)ヒト膣扁平上皮癌(A−431細胞)
ヒト膣扁平上皮癌A−431細胞は、金沢医科大学生化学教室から入手し、10%胎仔牛血清を含むRPMI−1640培地で37℃、5%CO2条件下に培養したものを用いた。
【0022】h)ヒト子宮頚癌(HeLa細胞)
ヒト子宮頚癌HeLa細胞は、Flow Labo Inc.から入手し、10%胎仔牛血清を含むDMSO培地で37℃、5%CO2条件下に培養したものを用いた。
【0023】i)ヒト胆道癌(HuCC−T1細胞)
ヒト胆道癌HuCC−T1細胞は、金沢医科大学生化学教室から入手し、10%胎仔牛血清を含むRPMI−1640培地で37℃、5%CO2条件下に培養したものを用いた。
【0024】j)マウス皮膚癌(メラノーマ)
マウス皮膚癌メラノーマB16(M4)細胞は、金沢医科大学生化学教室から入手し、10%胎仔牛血清を含むDMEM培地で37℃、5%CO2条件下に培養したものを用いた。
【0025】k)ヒト悪性リンパ腫ヒトB型悪性リンパ腫細胞は、金沢医科大学内科学教室から入手し、10%胎仔牛血清を含むRPMI−1640培地で37℃、5%CO2条件下に培養したものを用いた。
【0026】l)ヒト慢性骨髄性白血病(K562細胞)
ヒト慢性骨髄性白血病K562細胞は、金沢医科大学内科学教室から入手し、10%胎仔牛血清を含むRPMI−1640培地で37℃、5%CO2条件下に培養したものを用いた。
【0027】m)ヒト膵臓癌(ASPC−1細胞)
ヒト膵臓癌ASPC−1細胞は、Flow Labo.社から入手し、10%胎仔牛血清を含むRPMI−1640培地で37℃、5%CO2条件下に継代培養したものを用いた。
【0028】n)ヒト神経芽腫(IMR−132細胞)
ヒト神経芽腫IMR−132細胞は、国立衛生試験所から入手し、10%胎仔牛血清を含むDMEM培地(1%NEAA、50IU/mlペニシリン及び50μg/mlストレプトマイシンを含む)で37℃、5%CO2条件下に継代培養したものを用いた。
【0029】o)ヒト肺小細胞癌(SCCH−194細胞)
ヒト肺小細胞癌SCCH−194細胞は、(財)放射線影響研究所から入手し、10%胎仔牛血清を含むES培地(60μg/ml硫酸カナマイシンを含む)で37℃、5%CO2条件下に継代培養したものを用いた。
【0030】p)ヒト膀胱癌(T24細胞)
ヒト膀胱癌T24細胞は、
【0031】q)ヒト腎癌(VMRC−RCW細胞)
ヒト腎癌VMRC−RCW細胞は、(財)放射線影響研究所から入手し、10%胎仔牛血清を含むMEM培地(1%NEAA、4mM HEPESを含む)で37℃、5%CO2条件下に培養したものを用いた。
【0032】r)ヒト胃癌(NUGC−2細胞)
ヒト胃癌NUGC−2細胞は、(財)放射線影響研究所から入手し、10%胎仔牛血清を含むRPMI−1640培地(4mM
HEPESを含む)で37℃、5%CO2条件下に培養したものを用いた。
【0033】s)ヒト甲状腺癌(8305C細胞)
ヒト甲状腺癌8305C細胞は、(財)放射線影響研究所から入手し、10%胎仔牛血清を含むMEM培地(1%NEAA、4mM HEPESを含む)で37℃、5%CO2条件下に培養したものを用いた。
【0034】t)ヒト乳癌(MRK−nu−1細胞)
ヒト乳癌MRK−nu−1細胞は、東京大学医科学研究所から入手し、10%胎仔牛血清を含むDM−160培地で37℃、5%CO2条件下に培養したものを用いた。
【0035】u)ヒト肝癌(HuH−7細胞)
ヒト肝癌HuH−7細胞は、岡山大学癌源研究施設から入手し、1%胎仔牛血清を含むRPMI−1640培地(0.2%ラクトアルブミン水解物を含む)で37℃、5%CO2条件下に培養したものを用いた。
【0036】v)ヒト卵巣癌(TYK−nu細胞)
ヒト卵巣癌TYK−nu細胞は、(財)食品薬品安全センター秦野研究所から入手し、10%胎仔牛血清を含むMEM培地で37℃、5%CO2条件下に培養したものを用いた。
【0037】w)ヒト絨毛上皮癌(BeWo細胞)
ヒト絨毛上皮癌BeWo細胞は、国立衛生試験所から入手し、15%胎仔牛血清を含むHam's F12(K)培地で37℃、5%CO2条件下に培養したものを用いた。
【0038】x)ヒト正常線維芽細胞(N6KA細胞)
ヒト正常線維芽細胞N6KA細胞は、金沢医科大学生化学教室から入手し、10%胎仔牛血清を含むDMEM培地(50IU/mlペニシリン及び50μg/mlストレプトマイシンを含む)で37℃、5%CO2条件下に培養したものを用いた。
【0039】y)ヒト正常気管上皮細胞ヒト正常気管上皮細胞は、金沢医科大学病院病理剖検材料から気管上皮をトリプシン処理で採取し、10%胎仔牛血清を含むDMEM培地(50IU/mlペニシリン及び50μg/mlストレプトマイシンを含む)で37℃、5%CO2条件下に培養したものを用いた。
【0040】z)ヒト正常末梢血リンパ球ヒト正常末梢血リンパ球は、健常成人男子の末梢血から、Ficoll−Hypaque遠心法にてリンパ球画分を採取した。この細胞を96穴マイクロプレートに5×103細胞/cm2の密度になるように10%胎仔牛血清を含むRPMI−1640培地で37℃、5%CO2条件下に培養したものを用いた。
【0041】aa)ヒト正常腎細胞ヒト正常腎細胞は、金沢医科大学病院泌尿器科において腫瘍等でネフレクトミーされた腎材料から正常腎細胞をコラゲナーゼ処理で採取し、10%胎仔牛血清を含むMEM培地(1%NEAA、4mM HEPES及び60μg/ml硫酸カナマイシンを含む)で37℃、5%CO2条件下に培養したものを用いた。
【0042】(5)実験成績上に列挙した各種悪性腫瘍およびヒト正常細胞に対するNFDの作用(増殖抑制作用及び致死作用)を96穴マイクロプレートでの生細胞数を測定することにより調べた。尚、コントロールとして、NFDを含まない培地での細胞の増殖を調べた。その結果を図1〜27に示す。尚、各図に於ける記号の意義は以下の通りである。
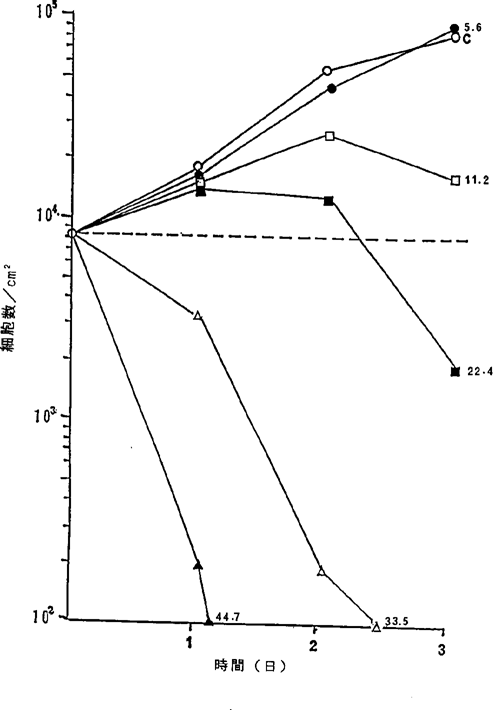
【0043】図1中、○−○はNFDを含まないコントロール(C)、●−●は5.6ng/ml、□−□は11.2ng/ml、■−■は22.4ng/ml、△−△は33.5ng/ml、▲−▲は44.7ng/mlのNFD添加を示す。
【0044】図2中、○−○はNFDを含まないコントロール(C)、●−●は5.6ng/ml、□−□は16.8ng/ml、■−■は27.9ng/ml、△−△は44.7ng/ml、▲−▲は55.9ng/mlのNFD添加を示す。
【0045】図3中、○−○はNFDを含まないコントロール(C)、●−●は11.2ng/ml、□−□は22.4ng/ml、■−■は33.5ng/ml、△−△は44.7ng/ml、▲−▲は55.9ng/mlのNFD添加を示す。
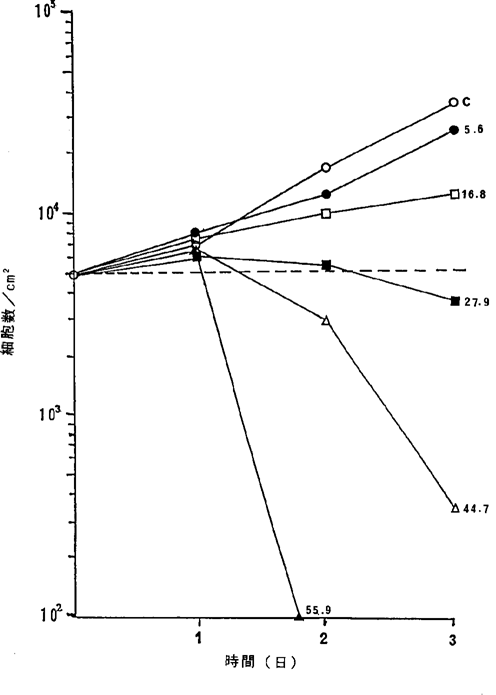
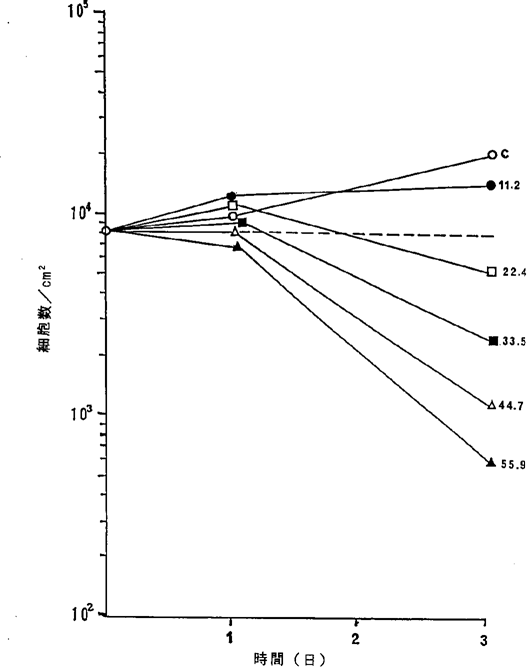
【0046】図4中、○−○はNFDを含まないコントロール(C)、●−●は11.2ng/ml、□−□は22.4ng/ml、■−■は33.5ng/ml、△−△は44.7ng/ml、▲−▲は55.9ng/mlのNFD添加を示す。図1R>1〜4に示されるように11.2〜16.8ng/mlのNFDによってヒト肺癌細胞の増殖はほとんど完全に抑制され、33.5〜55.4ng/mlの濃度でほとんどすべての癌細胞が壊死することが確認された。
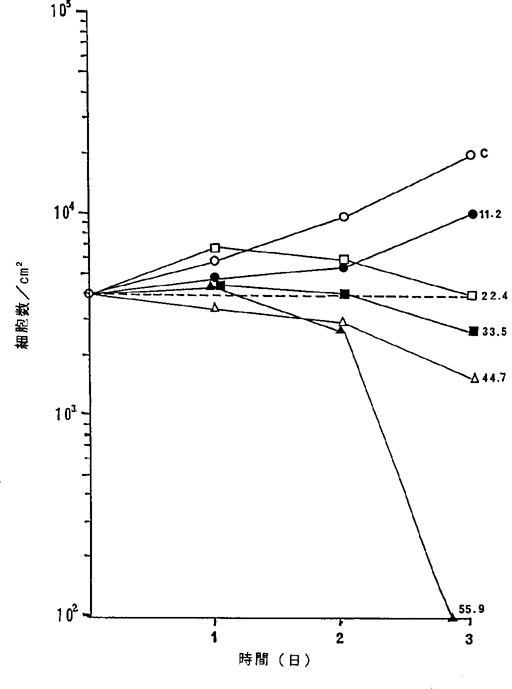
【0047】図5中、○−○はNFDを含まないコントロール(C)、●−●は11.2ng/ml、□−□は22.4ng/ml、■−■は33.5ng/ml、△−△は44.7ng/ml、▲−▲は55.9ng/mlのNFD添加を示す。図5R>5に示されるように22.4〜33.5ng/mlのNFDによってヒト結腸腺癌細胞の増殖はほとんど完全に抑制され、44.7〜55.9ng/mlの濃度でほとんどすべての癌細胞が壊死することが確認された。
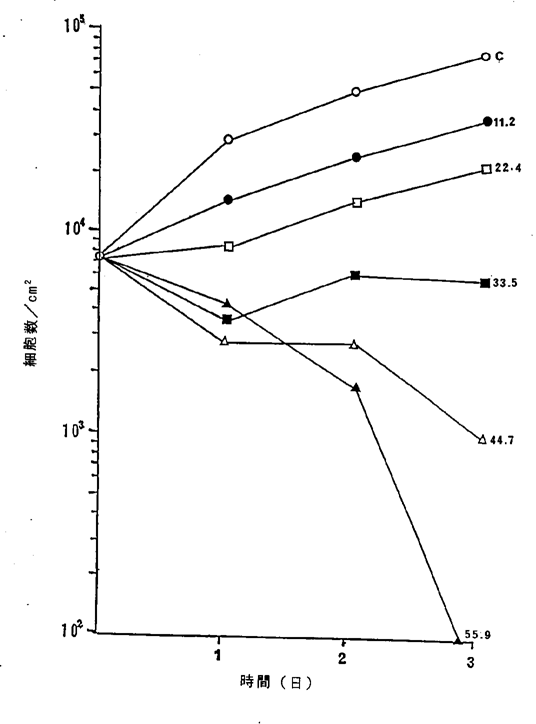
【0048】図6中、○−○はNFDを含まないコントロール(C)、●−●は11.2ng/ml、□−□は22.4ng/ml、■−■は33.5ng/ml、△−△は44.7ng/ml、▲−▲は55.9ng/mlのNFD添加を示す。図6R>6に示されるように11.2ng/mlのNFDによってヒト結腸腺癌細胞の増殖はほとんど完全に抑制され、22.4〜55.9ng/mlの濃度でほとんどすべての癌細胞が壊死することが確認された。
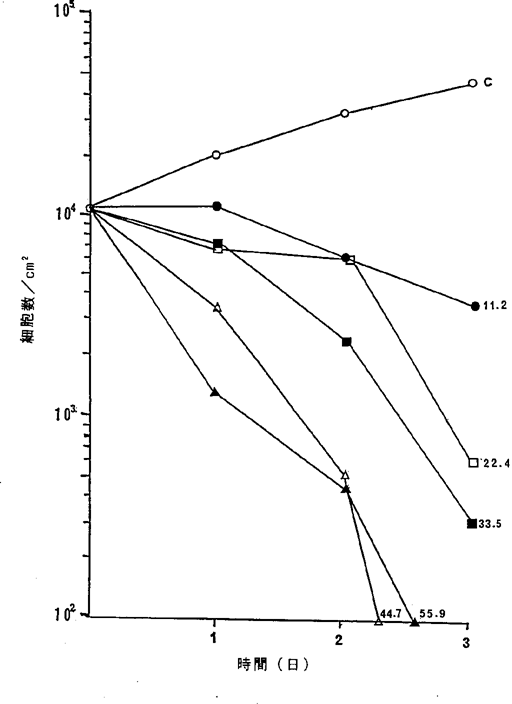
【0049】図7中、○−○はNFDを含まないコントロール(C)、●−●は16.8ng/ml、□−□は22.8ng/ml、■−■は27.9ng/mlのNFD添加を示す。図7に示されるように27.9ng/mlのNFDによってヒト膣扁平上皮癌細胞の増殖はほとんど完全に抑制されることが確認された。
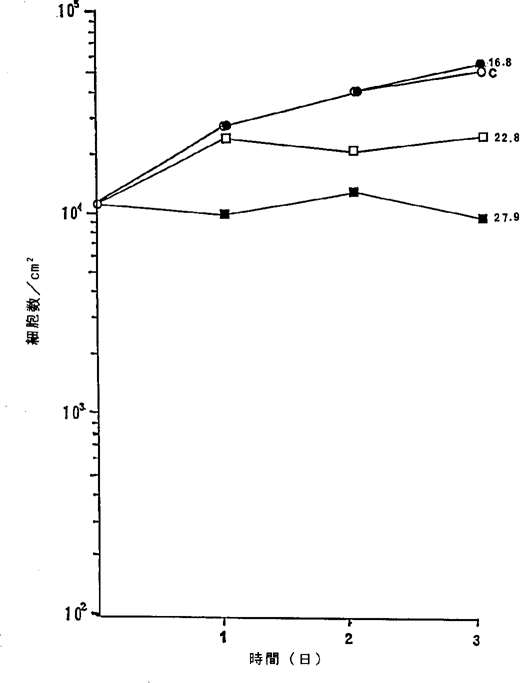
【0050】図8中、○−○はNFDを含まないコントロール(C)、●−●は5.6ng/ml、□−□は11.2ng/ml、■−■は16.8ng/ml、△−△は22.4ng/ml、▲−▲は27.9ng/mlのNFD添加を示す。図8に示されるように22.4ng/mlのNFDによってヒト子宮頚癌細胞の増殖はほとんど完全に抑制され、27.9ng/mlの濃度で癌細胞が壊死することが確認された。
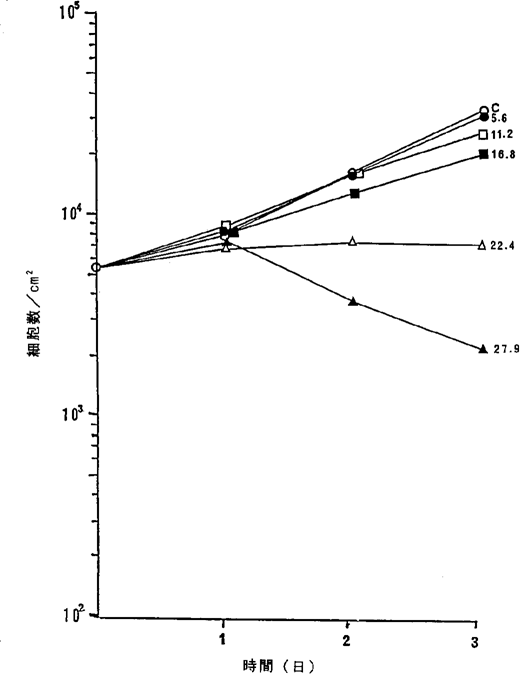
【0051】図9中、○−○はNFDを含まないコントロール(C)、●−●は11.2ng/ml、□−□は16.8ng/ml、■−■は22.4ng/ml、△−△は27.9ng/mlのNFD添加を示す。図9に示されるように22.4ng/mlのNFDによってヒト胆道癌細胞の増殖はほとんど完全に抑制され、27.9ng/mlの濃度で癌細胞が壊死することが確認された。
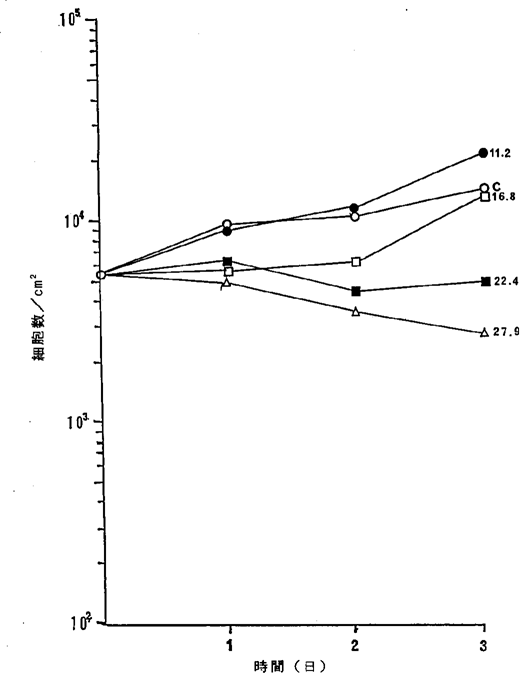
【0052】図10中、○−○はNFDを含まないコントロール(C)、●−●は5.6ng/ml、□−□は11.2ng/ml、■−■は16.8ng/ml、△−△は22.4ng/ml、▲−▲は33.5ng/mlのNFD添加を示す。図1010に示されるように11.2ng/mlのNFDによってマウス皮膚癌メラノーマ細胞の増殖はほとんど完全に抑制され、16.8〜33.5ng/mlの濃度でほとんどすべての癌細胞が壊死することが確認された。
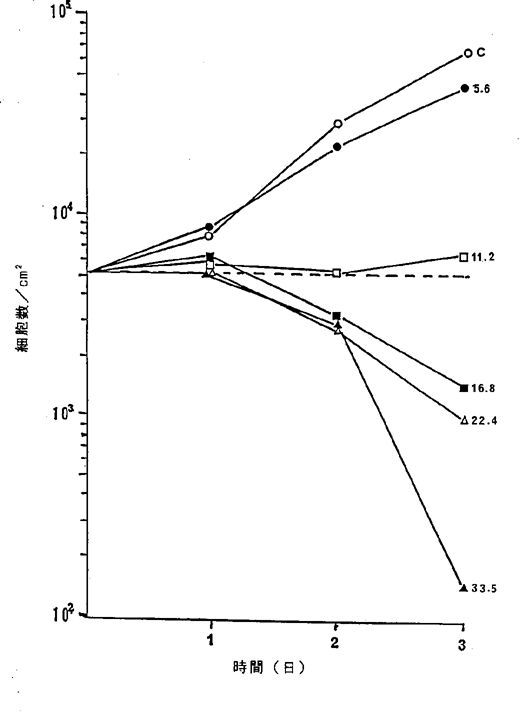
【0053】図11中、○−○はNFDを含まないコントロール(C)、●−●は11.2ng/ml、□−□は22.4ng/ml、■−■は33.5ng/ml、△−△は44.7ng/ml、▲−▲は55.9ng/mlのNFD添加を示す。図11に示されるように11.2〜55.9ng/mlのNFDによってヒトB型悪性リンパ腫細胞は壊死することが確認された。
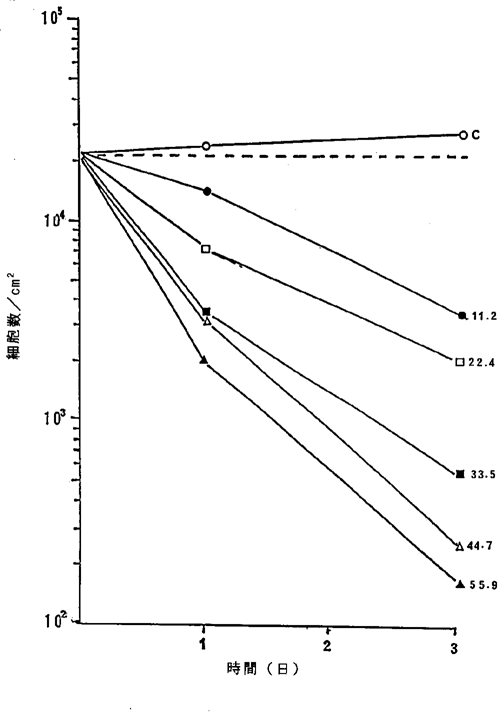
【0054】図12中、○−○はNFDを含まないコントロール(C)、●−●は11.2ng/ml、□−□は22.4ng/ml、■−■は27.9ng/ml、△−△は33.5ng/ml、▲−▲は44.7ng/ml、×−×は55.9ng/mlのNFD添加を示す。図12に示されるように11.2〜22.4ng/mlのNFDによってヒト慢性骨髄性白血病細胞の増殖は抑制され、27.9〜55.9ng/mlのNFDによって壊死することが確認された。
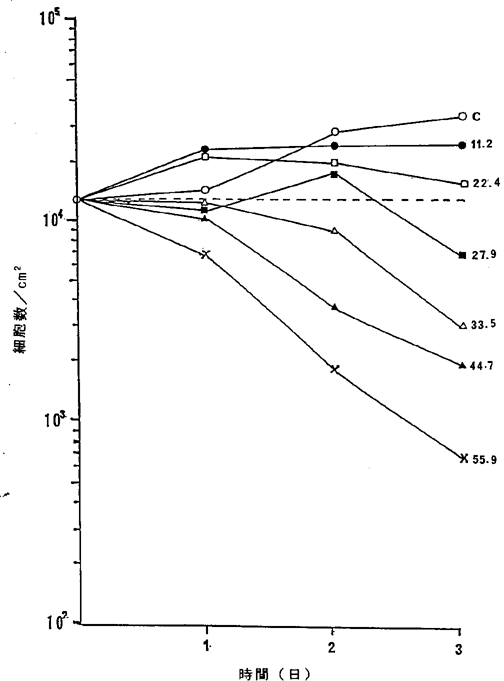
【0055】図13中、○−○はNFDを含まないコントロール(C)、●−●は5.6ng/ml、□−□は11.2ng/ml、■−■は22.4ng/ml、△−△は27.9ng/ml、▲−▲は33.5ng/ml、×−×は44.7ng/mlのNFD添加を示す。図13に示されるように33.5ng/mlのNFDによってヒト膵臓癌細胞の増殖はほとんど完全に抑制され、44.7ng/mlの濃度で癌細胞が壊死することが確認された。
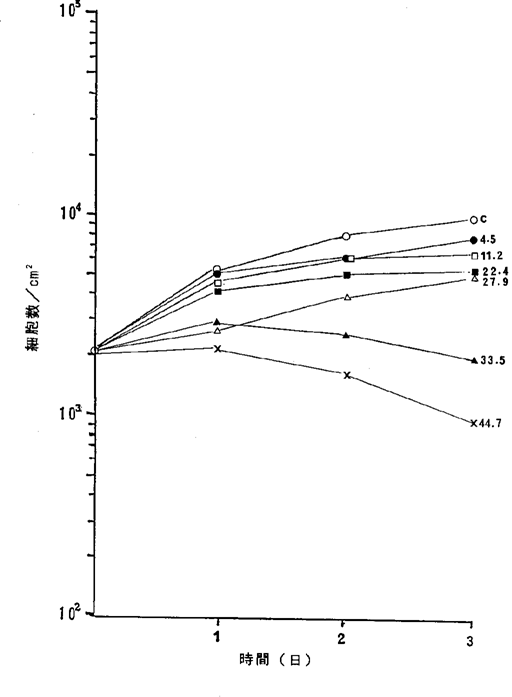
【0056】図14中、○−○はNFDを含まないコントロール(C)、●−●は5.6ng/ml、□−□は16.8ng/ml、■−■は27.9ng/ml、△−△は44.7ng/ml、▲−▲は55.9ng/mlのNFD添加を示す。図1414に示されるように44.7ng/mlのNFDによってヒト神経芽腫細胞の増殖はほとんど完全に抑制され、55.9ng/mlの濃度で癌細胞が壊死することが確認された。
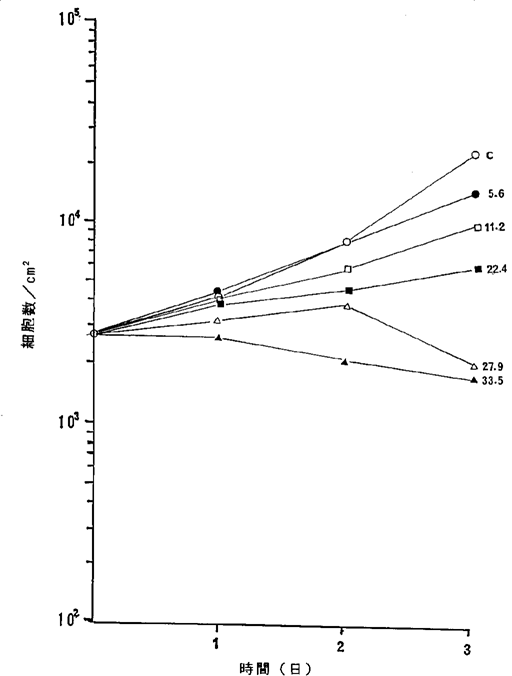
【0057】図15中、○−○はNFDを含まないコントロール(C)、●−●は10ng/ml、□−□は20ng/ml、■−■は30ng/ml、△−△は40ng/ml、▲−▲は50ng/mlのNFD添加を示す。図15に示されるように30ng/mlのNFDによってヒト肺小細胞癌細胞の増殖はほとんど完全に抑制され、40〜60ng/mlの濃度で癌細胞が壊死することが確認された。
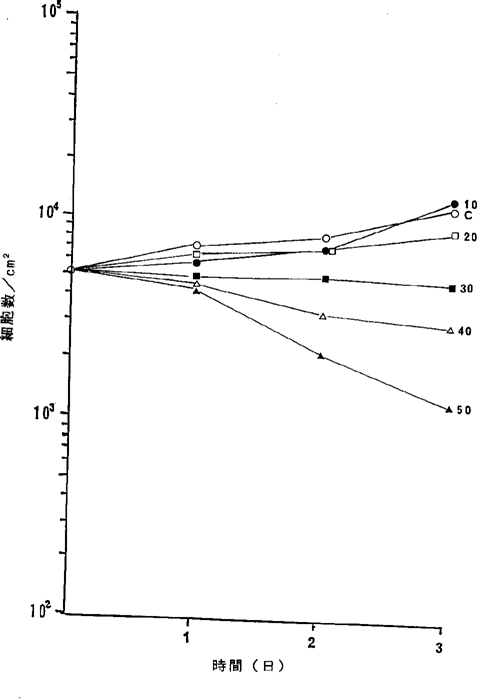
【0058】図16中、○−○はNFDを含まないコントロール(C)、●−●は5.7ng/ml、□−□は11ng/ml、■−■は23ng/ml、△−△は46ng/ml、▲−▲は68ng/mlのNFD添加を示す。図16に示されるように23ng/mlのNFDによってヒト膀胱癌細胞の増殖はほとんど完全に抑制され、46ng/mlの濃度で癌細胞が壊死することが確認された。
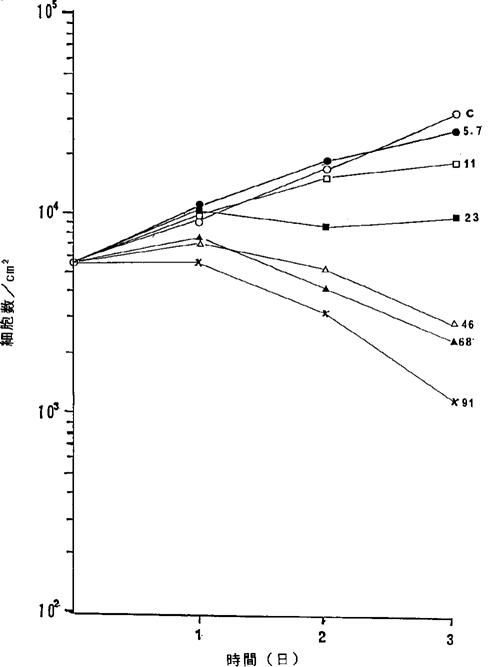
【0059】図17中、○−○はNFDを含まないコントロール(C)、●−●は17ng/ml、□−□は33ng/ml、■−■は50ng/ml、△−△は90ng/ml、▲−▲は280ng/mlのNFD添加を示す。図17に示されるように17ng/mlのNFDによってヒト腎癌細胞の増殖はほとんど完全に抑制され、50ng/mlの濃度でほとんどすべての癌細胞が壊死することが確認された。
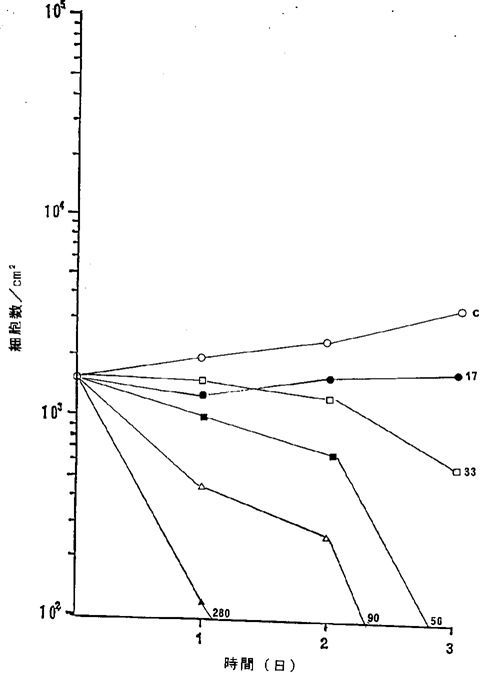
【0060】図18中、○−○はNFDを含まないコントロール(C)、●−●は17ng/ml、□−□は33ng/ml、■−■は50ng/ml、△−△は90ng/ml、▲−▲は170ng/mlのNFD添加を示す。図18に示されるように33ng/mlのNFDによってヒト胃癌細胞の増殖はほとんど完全に抑制され、50ng/mlの濃度で癌細胞が壊死することが確認された。
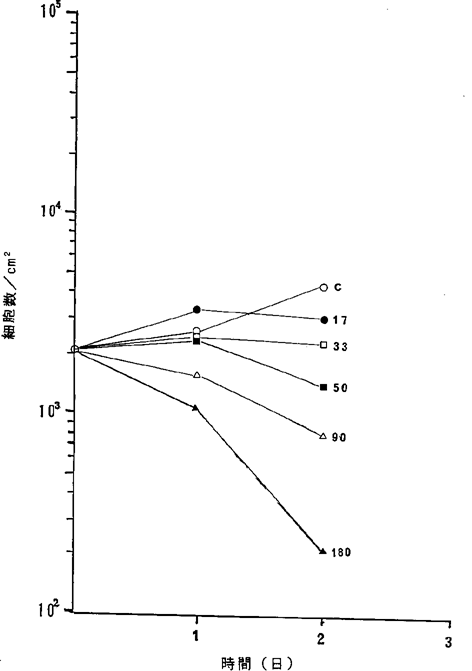
【0061】図19中、○−○はNFDを含まないコントロール(C)、●−●は17ng/ml、□−□は33ng/ml、■−■は50ng/ml、△−△は90ng/ml、▲−▲は280ng/mlのNFD添加を示す。図19に示されるように28ng/mlのNFDによってヒト甲状腺癌細胞の増殖はほとんど完全に抑制され、51ng/mlの濃度で癌細胞が壊死することが確認された。
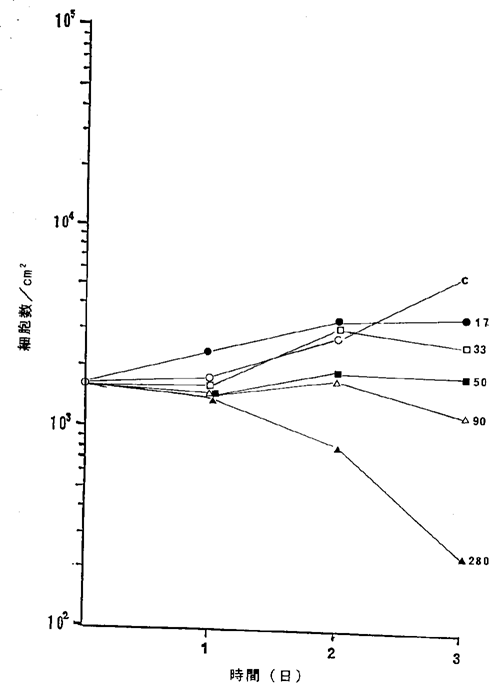
【0062】図20中、○−○はNFDを含まないコントロール(C)、●−●は17ng/ml、□−□は33ng/ml、■−■は50ng/ml、△−△は90ng/ml、▲−▲は280ng/mlのNFD添加を示す。図20に示されるように33ng/mlのNFDによってヒト乳癌細胞の増殖はほとんど完全に抑制され、50ng/ml以上の濃度で癌細胞が壊死することが確認された。
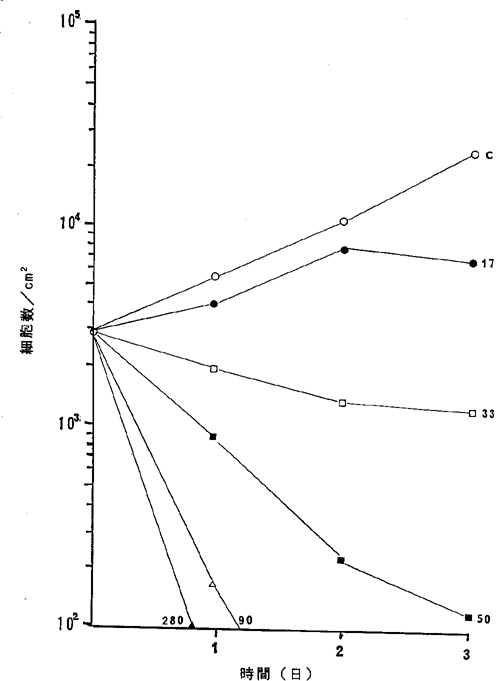
【0063】図21中、○−○はNFDを含まないコントロール(C)、●−●は5.0ng/ml、□−□は7.5ng/ml、■−■は20ng/ml、△−△は30ng/ml、▲−▲は40ng/mlのNFD添加を示す。図21に示されるように20ng/mlのNFDによってヒト肝癌細胞の増殖はほとんど完全に抑制され、30ng/ml以上の濃度で癌細胞が壊死することが確認された。
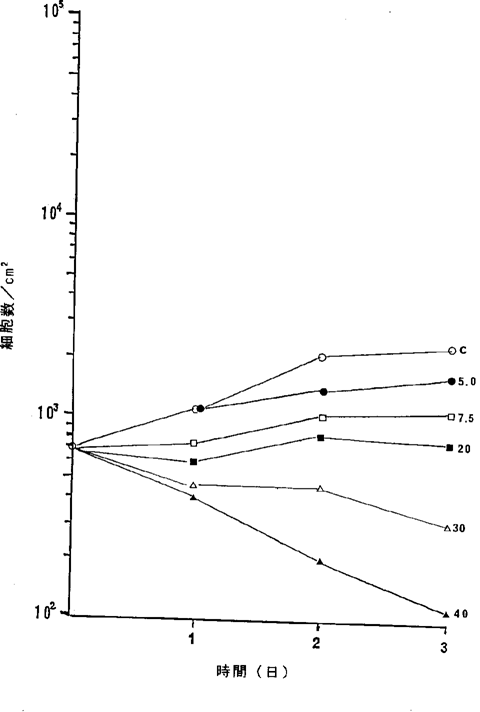
【0064】図22中、○−○はNFDを含まないコントロール(C)、●−●は10ng/ml、□−□は20ng/ml、■−■は40ng/ml、△−△は60ng/ml、▲−▲は80ng/mlのNFD添加を示す。図22に示されるように20ng/mlのNFDによってヒト卵巣癌細胞の増殖はほとんど完全に抑制され、40ng/ml以上の濃度でほとんどすべての癌細胞が壊死することが確認された。
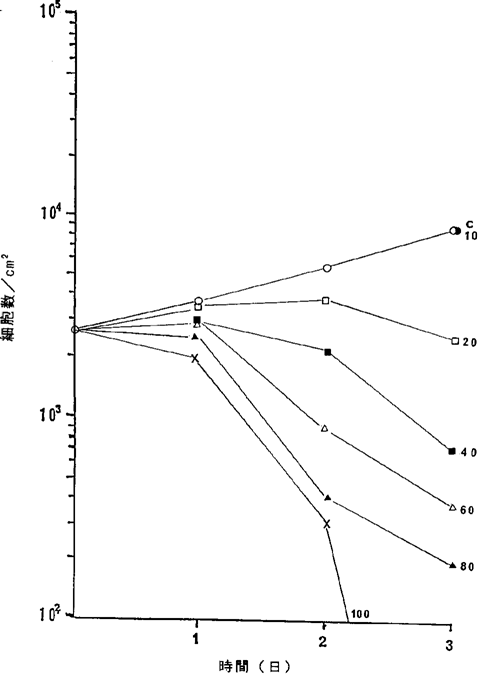
【0065】図23中、○−○はNFDを含まないコントロール(C)、●−●は5.7ng/ml、□−□は11.4ng/ml、■−■は22.8ng/ml、△−△は34.3ng/ml、▲−▲は45.7ng/mlのNFD添加を示す。図2323に示されるように34.3ng/mlのNFDによってヒト絨毛上皮癌細胞の増殖はほとんど完全に抑制され、45.7ng/mlの濃度で壊死することが確認された。
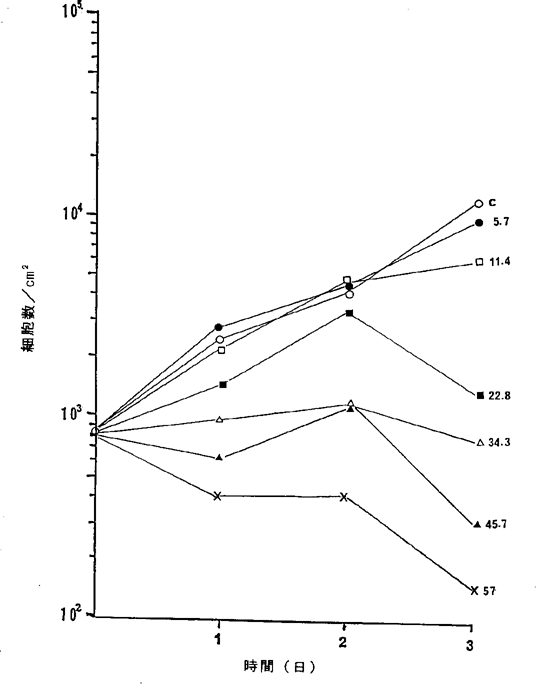
【0066】図24中、○−○はNFDを含まないコントロール(C)、●−●は55.9ng/mlのNFD添加を示す。
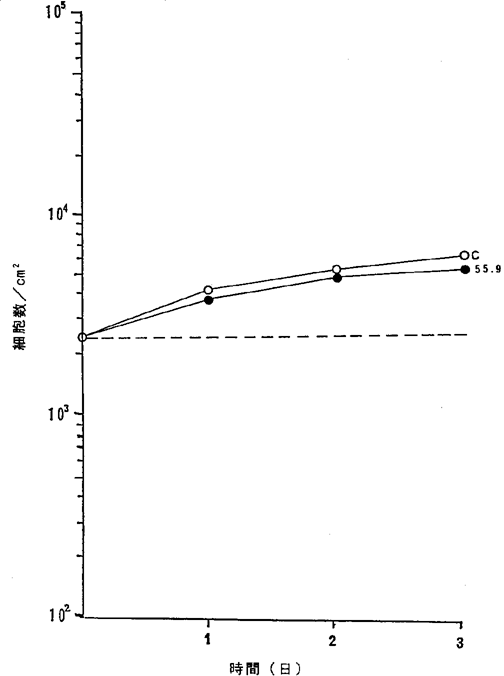
【0067】図25中、○−○はNFDを含まないコントロール(C)、●−●は55.9ng/mlのNFD添加を示す。
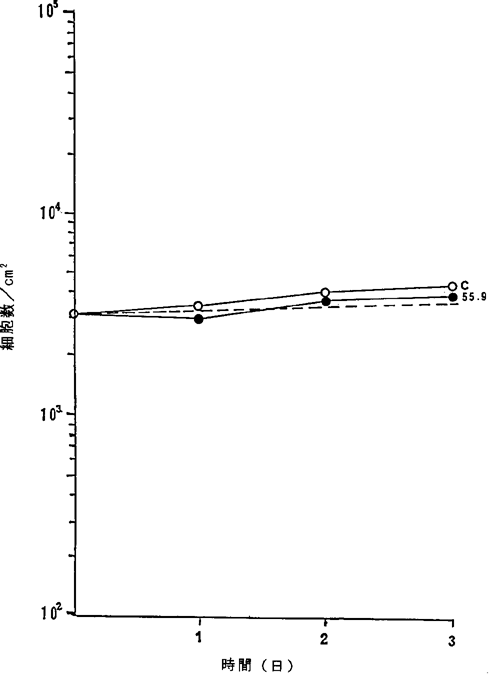
【0068】図26中、○−○はNFDを含まないコントロール(C)、●−●は16.8ng/ml、□−□は33.5ng/ml、■−■は55.9ng/mlのNFD添加を示す。
【0069】図27中、○−○はHNFDを含まないコントロール(C)、●−●は30ng/ml、□−□は50ng/ml、■−■は100ng/mlのHNFD添加を示す。図27に示されるように、100ng/mlのNFDによって正常腎細胞の増殖が抑制されるのみであった。図24R>4、25、26、27に示されるように、前記癌細胞を死滅させる濃度のNFDによってはヒト正常線維芽細胞、ヒト正常気管上皮細胞、ヒト正常末梢血リンパ球、ヒト正常腎細胞の増殖は抑制されないこと、また死に至らないことが確認された。
【0070】(6)50%増殖阻害濃度(LD50、IC50値)
図1〜12の培養3日目に於けるコントロール(NFD無添加)に対するNFD添加時の生存細胞数の割合による各癌細胞の生存率から、増殖を50%阻害するNFD濃度(LD50、IC50値)を求め、表1にまとめた。
【0071】
【表1】
NFDのヒト、マウス悪性腫瘍及び正常細胞に対する50%増殖阻害濃度(LD50値、IC50値)
細胞名 LD50(IC50)(ng/ml)ヒト肺腺癌A−549細胞
9.5ヒト肺腺癌VMRC−LCD細胞 13ヒト肺腺癌SK−LU−1細胞 17ヒト肺扁平上皮癌Calu−1細胞 17ヒト結腸腺癌WiDr細胞
11ヒト前立腺癌LNCaP細胞 1.7ヒト膣扁平上皮癌A−431細胞
21ヒト子宮頚癌HeLa細胞 18ヒト胆道癌HuCC−T1細胞 20マウス皮膚癌メラノーマB16(M4)細胞 6.7ヒトB型悪性リンパ腫細胞
5.6ヒト慢性骨髄性白血病K562細胞 14ヒト膵臓癌ASPC−1細胞 17ヒト神経芽腫IMR−132細胞 10ヒト肺小細胞癌SCCH−194細胞
10ヒト膀胱癌T24細胞 21ヒト腎癌VMRC−RCW細胞 19ヒト胃癌NUGC−2細胞 17ヒト甲状腺癌8305C細胞 25ヒト乳癌MRK−nu−1細胞 12ヒト肝癌HuH−7細胞 5.5ヒト卵巣癌TYK−nu細胞 17ヒト絨毛上皮癌BeWo細胞 18−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−ヒト正常線維芽細胞N6KA細胞
84ヒト正常気管上皮細胞 >55ヒト正常末梢血リンパ球 84ヒト正常腎細胞 65 【0072】その結果、上記実験に用いた癌腫、血液癌に対するLD50値はすべて5.5〜25ng/mlの範囲にあった。図13〜15の培養3日目に於ける正常細胞に対するNFDのLD50値も表1に示してあり、およそ55〜84ng/mlの範囲と計算された。
【0073】実施例3 マウスの肺二段階発癌抑制試験動物実験として雌ICRマウスを用い、15匹を1つのケージに入れて自由に固形飼料と飲料水を摂取できる状態に維持し、実験をすすめた。実験前一週間飼育した後、まず6週齢のマウス背部に4−ニトロキノリン−N−オキシド(4NQO)をオリーブ油とコレステロール(20:1)の溶液に溶かした試薬を体重あたり10mg/kgの量で皮下注射し、その5週間後から8%グリセロールを発癌プロモーターとして自由に経口摂取させた。陽性のコントロール実験は、4NQO処理と8%グリセロールを摂取した群として、被験化合物の群は、0.1ng/mlNFDを含む8%グリセロール液としたものを自由摂取させ25週間実験を行った。実験開始30週間目において、頚部脱臼後、剖検にて肺をホルマリン固定して取り出した。実体顕微鏡下において、肺に発現した腺腫を観察その数を計算し、陽性コントロール群とNFDを摂取させた群と比較した。表2が判定に用いた結果である。表2の結果から実験開始後30週の段階でNFDを摂取させた実験群は陽性コントロールに比べ、腺腫の発現が1/3に減少し有意に肺腺腫形成を抑制した。
【0074】
【表2】
マウス肺における腺腫の発現数と発現率 実験群 発現した マウス一匹あたり 腺腫が発現した 腺腫数 の腺腫数 マウスの率 I
飲料水として 0 0 0 水のみ摂取II 飲料水として8% 0 0 0 グリセロールのみ摂取III 4NQOを摂取後 3 0.2 13.3 飲料水として水のみ摂取IV 4NQOを摂取後 48 3.2 100 飲料水として8% グリセロールのみ摂取V 4NQOを摂取後 9
0.6 33.3
0.1ng/ml NFDを含む 8%グリセロール溶液 とし経口摂取させた 【0075】実施例4
マウス皮膚二段階発癌抑制試験動物実験として雌ICRマウスを用い、15匹を1つのケージに入れて実験終了まで、自由に市販の固形飼料と飲料水を摂取できる状態に維持し実験を進めた。6週齢のマウス購入後、その背部を剃毛、次の日にイニシエーターとして390nmolの7,12−ジメチルベンズ(a)アントラセン(DMBA)を0.1mlのアセトン溶液として剃毛箇所に塗布した。1週間後から、同じ箇所にプロモーターとして、1.7nmolの12−O−テトラデカノイルフォルボール−13−アセトート(TPA)を同じく0.1mlのアセトン溶液として週二回塗布し、この操作を20週間連続して続けた。被験試薬としてそれぞれプロモーター処理の1時間前に0.1mlのアセトンを塗布する群と85nmolのNFDを0.1mlのアセトン溶液として塗布の群を、1群を15匹として実験を行いNFDで処理した群の抑制効果を観察した。
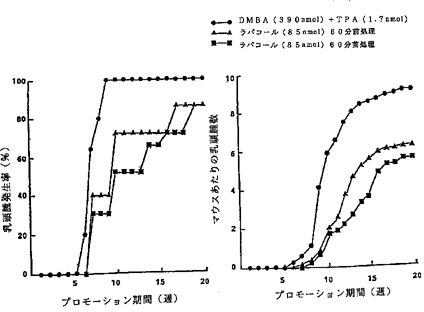
【0076】それぞれの結果の判定は週に1回、1mm以上の乳頭腫について、各群のマウスの匹数あたり乳頭腫を有するマウスの匹数を百分率で示した値と、マウスあたりの発現した乳頭腫の数について行った。図28がその結果でNFDの作用を示し、図29は比較被験試薬であるラパコールの作用を示す。
【0077】以上の実施例3および4から、NFDは発癌プロモーション阻害剤として使用することができ、癌予防薬として使用することが可能であることが判明した。NFDを抗癌剤として使用するには、1日3回の経口投与が望ましい。1日の投与量は、成人では0.15〜1.5mgであり、小児では約半量、乳幼児は6分の1量であることが望ましい。投与方法は経口、非経口投与のいずれも可能であるが前者が好ましい。
【0078】製造例NFD1.5mgに対し、賦形剤として乳糖66.5mg、結合剤としてデンプンのり10mg、崩壊剤としてデンプン20mg、滑沢剤としてステアリン酸マグネシウム2mgを加え、よく混合して打錠する。NFD1.5mgを含有する100mgの錠剤を得る(合計100mg)。
【図面の簡単な説明】
【図1】
ヒト肺腺癌A−549細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図2】
ヒト肺腺癌VMRC−LCD細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図3】
ヒト肺腺癌SK−LU−1細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図4】
ヒト肺扁平上皮癌Calu−1細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図5】
ヒト結腸腺癌WiDr細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図6】
ヒト前立腺癌LNCaP細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図7】 ヒト膣扁平上皮癌A−431細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図8】
ヒト子宮頚癌HeLa細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図9】
ヒト胆道癌HuCC−T1細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図10】
マウス皮膚癌メラノーマB16(M4)細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図11】
ヒトB型悪性リンパ腫細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図12】
ヒト慢性骨髄性白血病K562細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図13】
ヒト膵臓癌ASPC−1細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図14】
ヒト神経芽腫IMR−132細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図15】
ヒト肺小細胞癌SCCH−194細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図16】
ヒト膀胱癌T24細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図17】
ヒト腎癌VMRC−RCW細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図18】
ヒト胃癌NUGC−2細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図19】
ヒト甲状腺癌8305C細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図20】
ヒト乳癌MRK−nu−1細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図21】
ヒト肝癌HuH−7細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図22】
ヒト卵巣癌TYK−nu細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図23】
ヒト絨毛上皮癌BeWo細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図24】
ヒト正常線維芽細胞N6KA細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図25】
ヒト正常気管上皮細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図26】
ヒト正常末梢血リンパ球細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図27】
ヒト正常腎細胞に対するNFDの増殖阻害及び致死作用を示すグラフ。
【図28】
NFDによる発癌プロモーション抑制効果を示すグラフ。
【図29】
比較被験試薬であるラパコールによる発癌プロモーション抑制効果を示すグラフ。
【図1】
【図2】
【図3】
【図4】
【図5】
【図6】
【図7】
【図8】
【図9】
【図10】
【図11】
【図12】
【図13】
【図14】
【図15】
【図16】
【図17】
【図18】
【図19】
【図20】
【図21】
【図22】
【図23】
【図24】
【図25】
【図26】
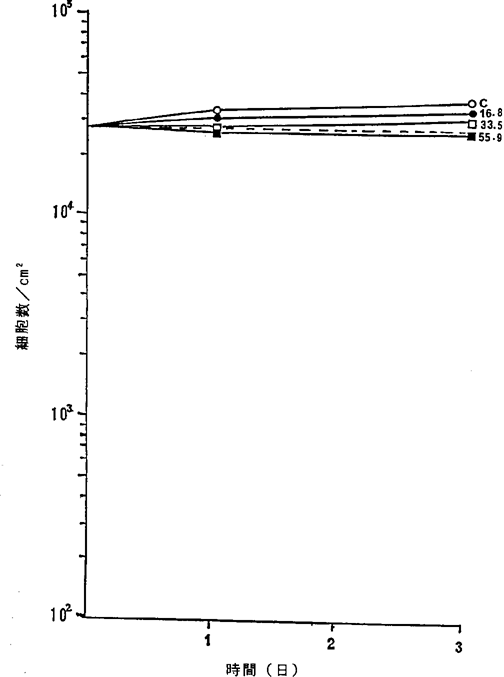
【図27】
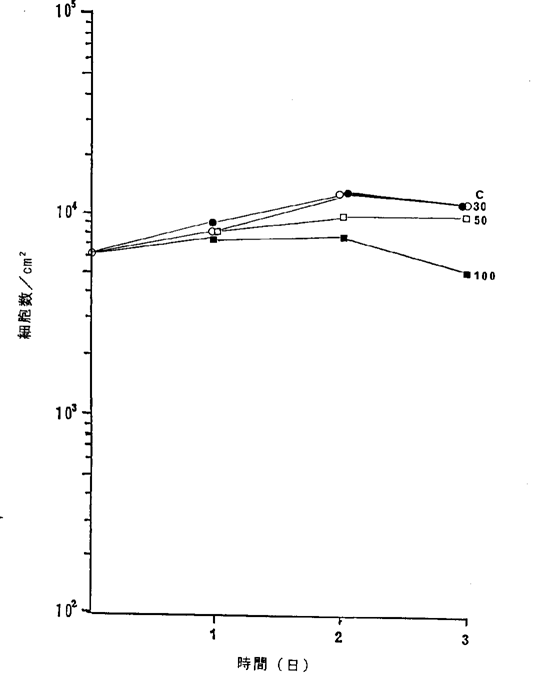
【図28】
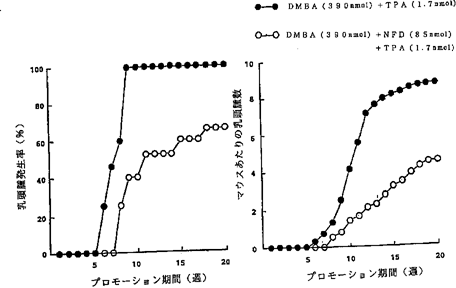
【図29】